Systematik der Polygonaceae (Rolf Wißkirchen)
| Hinweis: | Dieser Artikel ist mit dem Autornamen gekennzeichnet und die Mitarbeit ist auf Rolf Wißkirchen beschränkt. Auf der Diskussionseite sind Kritik und Verbesserungsvorschläge jedoch sehr willkommen. |
| Zitiervorschlag: | Teil von: Wißkirchen, Rolf 2011. Polygonaceae – Bestimmungsschlüssel für die in Deutschland und angrenzenden Regionen wachsenden Knöterichgewächse. http://offene-naturfuehrer.de/wiki/Polygonaceae_-_Bestimmungsschlüssel_für_die_in_Deutschland_und_angrenzenden_Regionen_wachsenden_Knöterichgewächse_(Rolf_Wißkirchen) Diese Arbeit ist eine Originalarbeit, die erstmalig hier publiziert ist. |
Inhaltsverzeichnis
Allgemeine Charakterisierung
Die Polygonaceen sind eine weltweit verbreitete, systematisch isoliert stehende Pflanzenfamilie innerhalb der Zweikeimblättrigen-Ordnung Caryophyllales (Nelkengewächse). Die Plumbaginaceae sind ihre nächstverwandte Schwesterfamilie. Die Ochrea (Tute), ein röhriges Verwachsungsprodukt von Nebenblättern, gilt als markantestes Merkmal der Polygonaceen. Tatsächlich kennzeichnet sie nur einen Teil von ihnen. Sie fehlt weitestgehend in der Unterfamilie Eriogonoideae. Allen Polygonaceen gemeinsam sind folgende Merkmale: Die Blüten sind klein und haben eine doppelte Blütenhülle; der dreizählige, verwachsene Fruchtknoten enthält eine einzige grundständige, aufrecht stehende Samenanlage, die bei der Fruchtreife eine (fast immer von den Blütenblättern umhüllte) Nuss ausbildet. Ein weiteres spezifisches Merkmal ist, dass die Staubgefäße im äußeren Kreis meist paarweise stehen. Biochemisch fallen die Polygonaceen durch hohe Gehalte von Calciumoxalat und löslicher Oxalsäure auf.
Die Polygonaceen besitzen drei ausgeprägte Diversitätszentren. Das ursprünglichste davon liegt im subtropisch-tropischen Zentralamerika und im angrenzenden nördlichen Südamerika. Hier hat die frühere Unterfamilie Coccoloboideae ihren Schwerpunkt. Sekundäre Diversitätszentren befinden sich im östlichen Zentralasien (Schwerpunkt der Unterfamilie Polygonoideae) und im trockenen westlichen Nordamerika (Schwerpunkt der ehemaligen Unterfamilie Eriogonoideae s.str.). Auch wenn damit der Schwerpunkt der Familie heute in der nördlichen temperaten Zone liegt, sind die Polygonaceae ursprünglich eine tropische Holzpflanzen-Familie (Bäume, Sträucher, holzige Lianen). Die Tatsache, dass im westlichen tropischen Afrika und – jenseits des Atlantik – im östlichen tropischen Südamerika die stammesgeschichtlich ältesten Gattungen der Polygonaceen, nämlich Symmeria und Brunnichia s.l., gleichermaßen vorkommen, legt nahe, dass sie bereits vor der Kontinentalverschiebung ein gemeinsames Areal besaßen, der Ursprung der Polygonaceen also wohl auf dem alten Südkontinent „Gondwana“ zu suchen ist. Man könnte argumentieren, dass die Ursache des Vorkommen auf beiden Kontinenten eventuell auch mit vergleichsweise jungen Verschleppungen durch Meeresströmungen oder Vögeln zu erklären sei. Tatsächlich aber sind die Brunnichia-Pflanzen in Afrika und Amerika bereits so verschieden, dass sie zu verschiedenen Gattungen gehören, nämlich zu Brunnichia s.str. und Afrobrunnichia. Die schon vorher bekannten morphologischen Unterschiede wurden zuletzt durch molekulare gestützt (Sanchez & Kron 2009). Das spricht für ein hohes Alter der Trennung. Es veranschaulicht, wie sich Pflanzen auf auseinandertreibenden Kontinenten mit der Zeit zu eigenen Gattungen weiterentwickeln können.
Die Familie umfasst weltweit ca. 50 Gattungen und etwa 1170 Arten; in Deutschland sind es 9 Gattungen mit 45 Arten (incl. etablierte Hybriden) + 11 infraspezifische Taxa, insgesamt also 56 Taxa. "Flora Europaea 2.ed." (Webb 1993) unterscheidet 108 akzeptierte Arten sowie 134 Taxa insgesamt. Die "Flora of China" (Anjen et al. 2003) führt innerhalb der Unterfamilie Polygonoideae allein 238 Arten ohne Bastarde und infraspezifische Taxa, und in der "Flora of North America: North of Mexico" unterscheiden Freeman & Reveal 2005 sogar 441 Arten (281 Arten davon in der rein neuweltlichen Unterfamilie Eriogonoideae s.str.). Die morphologische und ökologische Bandbreite der Polygonaceen ist recht groß. Die Palette reicht von gerade mal 1 cm messenden Pflänzchen der Gattung Koenigia auf den schneeumtosten Pässen des Himalaya in 5000 m Höhe bis hin zu den 40 m hohen Tropenbäumen von Triplaris americana im Tiefland des Amazonas, von den fast blattlosen, trockenresistenten Rutensträuchern der Gattung Calligonum in den zentralasiatischen Halbwüsten bis hin zu den schwimmenden Krautteppichen des Wasserknöterich (Persicaria amphibia) in den Altwässern europäischer Auen.
Viele Gattungen der Knöterichfamilie sind bislang noch nicht umfassend bearbeitet worden. So verwundert es nicht, dass die Ergebnisse der seit 2003 angelaufenen molekularsystematischen Studien einiges an bevorstehenden Änderungen unseres begrenzten Jetztwissens erkennen lassen. Das allermeiste davon ist aber im Betrachtungsgebiet – Deutschland und angrenzende Regionen – nicht relevant. Die Flora des Gebietes ist zudem auch schon gut erforscht. Hier liegt definitiv kein Diversitätszentrum der Knöterichgewächse, bestenfalls ein Nebenschauplatz der Evolution, nämlich der von Kulturunkräutern, angefangen bei Ackerunkräutern wie Vogelknöterich (Polygonum aviculare s.str.), Windenknöterich (Fallopia convolvulus) und Acker- und Lein-Ampferknöterich (Persicaria lapathifolium subsp. pallida, subsp. leptoclada) über den Bastard-Ampfer (Rumex × pratensis) der Wiesen, Wegraine und Brachflächen bis hin zu übermannshohen Dickichten des Bastard-Staudenknöterich (Fallopia × bohemica) – alles Arten bzw. Sippen, die es ohne den Menschen nicht gäbe.
Systematische Gliederung
Hinsichtlich der Einteilung der Polygonaceen zeichnen sich im Moment größere Veränderungen ab. Ein neues, rein phylogenetisches Sytem ist jedoch noch nicht etabliert. Alle Autoren sind sich aber darin einig, dass die Polygonaceae aus drei Hauptgruppen bestehen. Jedoch gehen die Meinungen, wie diese Trias taxonomisch zu behandeln ist, also welche verwandtschaftlichen Beziehungen und Rangstufen man ihnen zumisst, auseinander. Dammer (1893) und Gross (1913) haben schon vor ca. 100 Jahren ein System mit drei Unterfamilien begründet, das im Prinzip heute noch funktioniert. Brandbyge (1993) war der Meinung, dass die Unterfamilien Coccoloboideae und Polygonoideae zu einer einzigen Unterfamilie Polygonoideae s.l. zusammen zu legen und einer zweiten Unterfamilie Eriogonoideae gegenüberzustellen seien. Diese Annahme hat sich jedoch als falsch erwiesen. Vielmehr zeigen alle neueren molekularen Ergebnisse einen viel engeren verwandtschaftlichen Zusammenhang zwischen den früheren Coccoloboideae und den Eriogonoideae. So haben zuerst Lamb-Frye & Kron (2003), dann Sanchez et al (2009) und zuletzt Burke et al. (2010) sich für eine weit gefasste Unterfamilie Eriogonoideae s.l. (= Eriogonoideae s.str. + Coccoloboideae) ausgesprochen. Die Untersuchungen haben aber auch gezeigt, dass die Situation an der Basis der Polygonaceen recht kompliziert ist und dass bestimmte Gruppen der holzigen "Coccoloboideae" paraphyletisch sind. Außerdem zweigt Afrobrunnichia noch unterhalb der Aufspaltung in die die zwei Hauptzweige (Unterfamilien) ab. Und ganz an der Basis erscheint neuerdings die tropische Holzgattung Symmeria. Würde man all diese Verzweigungen umsetzen, bräuchte man ein Arsenal an Rangstufen, und die Hauptmasse der Polygonaceae wäre dann nur noch auf der Rangstufe von Triben, Subtriben oder Rangstufen darunter zu klassifizieren, von der Unübersichtlichkeit einer solchen Gliederung gar nicht zu sprechen. Nur durch Zusammenfassung von stammesgeschichtlichen Verzweigungen, d.h. durch ein sinnvolles Maß an Abstraktion, lässt sich ein hypertrophes System vermeiden.
Nichtsdestotrotz kann sicher schon jetzt mit den Ergebnissen molekularsystematischer Forschung gearbeitet werden. Demzufolge werden zwei Unterfamilien, die Polygonoideae und die Eriogonoideae s.l. unterschieden (vgl. die APG (Angiosperm Phylogeny Group) Webseite). Eine weitergehende Gliederung ist angekündigt, liegt bislang aber noch nicht vor. Doch analog zu den früheren Einteilungen und unter Berücksichtigung der molekularen Ergebnisse könnten die bisherigen Coccoloboideae (mit den Triben Coccolobeae und Triplarieae) und die Eriogonoideae s.str. jeweils als Triben einer erweiterten Unterfamilie Eriogonoideae s.l. aufgefasst werden. Aus streng phylogenetischer Sicht wäre die Tribus Eriogoneae zwar nur noch als Subtribus der Triplarieae s.l. aufzufassen, da sie stammesgeschichtlich dieser Gruppe entspringt (es erklärt auch die durchgehende 3-Zähligkeit der Blüten in der Eriogonum-Verwandtschaft als quasi phylogenetischer bottleneck-Effekt). Ob eine so starke Herabstufung der früheren Unterfamilie Erigonoideae, eine Gruppe von hoher morphologischer Diversität und 325 Arten, wirklich sinnvoll ist, erscheint fraglich und wird daher hier nicht umgesetzt. Während die Unterfamilie Polygonoideae und die von der Unterfamilie Eriogonoideae s.str. jetzt zur Tribus herabgestuften Eriogoneae beides monophyletische Gruppen darstellen, erweisen sich die Coccolobeae und die Triplarieae als paraphyletisch. Die systematische Zugehörigkeit der sehr isoliert stehenden und auch morphologisch stark abweichenden Gattung Symmeria ist noch unklar. Möglichweise repräsentiert sie eine eigene Unterfamilie oder ist das Relikt einer heute fast ausgestorbenen eigenen, mit den Polygonaceen verwandten Familie. Afrobrunnichia dagegen ist mit Brunnichia vergleichsweise eng verwandt. Es ist daher sinnvoll, sie in die Coccolobeae einzubeziehen, auch wenn diese dadurch paraphyletisch werden. Eine Alternative insgesamt wäre die Reaktivierung der alten Gliederung in drei Unterfamilien Coccoloboideae, Polygonoideae und Eriogonoideae s.str. nach Dammer (1893) und Gross (1913), diese dann jeweils in zwei Triben untergliedert. Eine solche Einteilung hätte den Vorteil, die drei im Hinblick auf Morphologie und Diversifikation klar erkennbaren Hauptgruppen auf der gleicher Rangstufe führen zu können. Außerdem fällt auf, dass die neu umgrenzte Unterfamilie Eriogonoideae s.l. nur unbefriedigend diagnostisch fassbar ist. Zwischen diesen Polen — stammesgeschichtliche vs. morphologische Klassifikation — wird sich die Diskussion bewegen. Beide haben ihre Berechtigung.
Polygonoideae Eaton (U.Fam.)
monophyletisch, 22 Gattungen mit ca. 670 Arten: P6, P5 (P4, P3), Sträucher, Halbsträucher, Stauden, Kräuter und Lianen, Sproßverzweigung monopodial, mit Ochrea, Blätter wechelständig, Blüten ohne Involukrum, in der Regel 2 miteinander verwachsene ochrea-ähnliche Vorblätter, von Brandpilzen (Ustilaginales) befallen, Äußere Tepalen meist kleiner als innere, sehr selten behaart, Samenanlage stets orthotrop, Pollen tricolpat, gelegentlich polycolpat/porat, ein-vielzellige, ein-mehrreihige Haare (viele spezielle Typen), weltweit verbreitet, aber mit deutlichem Schwerpunkt in Asien (insbes. in China)
Rumiceae (Trib.)
- monophyletisch, 4 Gattungen mit ca. 250 Arten - P6, P4, (P5), (Halbsträucher), Stauden und Kräuter, Pollen tricolpat, Vorblätter 1, stark reduziert oder ganz fehlend, Anthrachinone als spezifisches chemotaxonomisches Merkmal, innerer Staubblattkreis teilweise ausgefallen, die Gattung Rumex fast weltweit verbreitet (aber wenig in den Tropen), Rheum und Oxria vor allem in Zentralasien, Emex im Mittelmeergebiet und in Südafrika.
- Emex (2) - Oxyria (2) - 'Rheum (ca. 40) - Rumex (ca. 200)
Polygoneae (Trib.)
- monophletisch, 18 Gattungen mit ca 420 Arten - P5, P4, (P3), Sträucher, Halbsträucher, Stauden, Lianen und Kräuter, Pollen tricolpat, teilw. aber auch zu polyporat/polycolpat* weiterentwickelt (Persicaria, Aconogonon), Anthrachinone nur bei Knorringia (möglicherweise ist Knorringia aus diesem und noch weiteren Gründen eine 5-zählige Rumiceen-Gattung), in der Regel mit 2 verwachsenen Vorblättern, Blüten oft stärker reduziert (insbes. bei Persicaria), Fruchtknoten teilweise aus nur 2 Karpellen (Persicaria, Atraphaxis) bestehend, von Brandpilzen (Ustilaginales) befallen, weltweit verbreitet (vor allem aber im südlichen Zentralasien und in Ostasien, Oxygonum und Harpagocarpus in Afrika, Polygonella in N-Amerika).
- Aconogonon (ca. 30) - Atraphaxis (ca. 27) - Bistorta (ca. 25) - Calligonum (ca. 80) - Fagopyrum (ca. 15) - Fallopia (ca. 15) - Hargapocarpus (1) - Homalocladium* (1) - Knorringia (1) - Koenigia* (6) - Muehlenbeckia (22) - Oxygonum (30) - Parapteropyrum (1) - Persicaria (100) - Polygonella* (9) - Polygonum (ca. 60) - Pteropyrum (5) - Pteroxygonum (1)
Eriogonoideae Arnott s.l. (U.Fam.)
± monophyletisch, 30-31 Gattungen mit ca. 500 Arten: P6, P5 (s.s. Reduktion zu P3), Bäume, Sträucher, Halb- und Zwergstäucher, Stauden und Kräuter, Sproßverzweigung monopodial oder sympodial, mit oder ohne Ochrea, Blätter wechelständig oder aufwärts gegen- bis quirlständig, Blüten mit oder ohne Involukrum, 2 miteinander verwachsene ochrea-ähnliche Vorblätter oder keine Vorblätter, nicht von Brandpilzen (Ustilaginales) befallen, Amerika (selten im tropischen Westafrika)
Coccolobeae (Trib.)
- paraphyletisch, 6 Gattungen, ca. 130 Arten - P5, Bäume, Sträucher oder holzige Lianen, Sproßverzweigung monopodial, Blätter wechelständig,, Samen mit ruminiertem (zerfurchtem) Endosperm, Funiculus teilweise sehr lang, Siebröhrenplastiden teilweise vom seltenen Pfs-Typ. Blüten ohne Involukrum, mit 2 verwachsenen ochrea-ähnlichen Vorblättern, Samenanlagen teilweise anatrop, Pollen tricolpat, Mittel- und Südamerika (Afrobrunnichia in Westafrika)
- Afrobrunnichia (2) - Antigonon (ca. 3) - Brunnichia (1) - Coccoloba (ca. 120) - Neomillspaughia (2) - Podopterus (3)
Triplarieae (Trib.)
- paraphyletisch, 4-5 Gattungen mit ca. 43 Arten - P6 (selten innerer Kreis zu fast P3 (Ruprechtia apetala reduziert), Bäume, Stäucher, Samen mit ruminiertem (zerfurchtem)Endosperm, Funiculus teilweise sehr lang, Siebröhrenplastiden teilweise vom seltenen Pfs-Typ, Blüten ohne Involukrum, mit 2 verwachsenen ochrea-ähnlichen Vorblättern, Samenanlagen teilweise anatrop, Pollen tricolpat, Mittel- und Südamerika (Symmeria auch im tropischen Afrika)
- Gymnopodium (3) - Leptogonum (1) - Ruprechtia (20) - Triplaris (18) - (? Symmeria (1) ?)
Erigoneae (Trib.)
- monophyletisch, 20 Gattungen, ca. 327 Arten: P6 (P5 nur bei der Gattung Lastarriaea), Sträucher, Halbsträucher, Stauden und Kräuter, fast stets ohne Ochrea (bei einigen Chorizanthe-Arten kleine Reste einer Ochrea), Sproß-, insbes. Infloreszenzverzweigung sympodial, Blätter aufwärts oft gegen- oder quirlständig, Blüten mit Involukrum (spezieller Hüllkelch unte den Blütenständen aus miteinander verwachsenen oder freien Hochblättern), ohne Vorblätter, Samenanlage stets orthotrop, Pollen tricolpat, nur einfache einzellige Haare, Nordamerika (selten Südamerika), in der Hauptsache auf die südwestliche trockene USA und das angrenzende Mexiko beschränkt, daneben Vertreter von 3 Gattungen auch in Südamerika (Chile)
- Acanthoscyphus (1) - Aristocapsa (1) - Centrostegia (1) - Chorizanthe (50) - Dedeckera (1) - Dodecahema (1) - Eriogonum (ca. 250) - Gilmania (1) - Goodmania (1) - Harfordia (1) - Hollisteria (1) - Johanneshowellia (2) - Lastarriaea (3) - Mucronea (2) - Nemacaulis (1) - Oxytheca (3) - Pterostegia (1) - Sidotheca (3) - Stenogonum (2) - Systenotheca (1)
Blütenbau
Der Blütenbau der Polygonaceen wird in den Bestimmungsschlüsseln hier und da angesprochen. Grobe Kenntnisse der Blütenverhältnisse sind also von Nutzen:
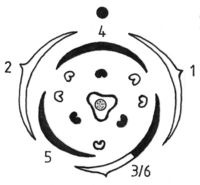
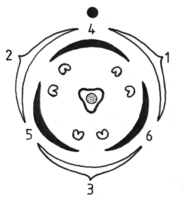
Zwei wichtige Blüten-Grundformeln treten bei den heimischen Polygonaceen nebeneinander auf: Zum einen 6-zählige Blüten (3 + 3 in zwei Kreisen) mit 6 oder 9 Staubgefäßen und 3-zähligen Fruchtknoten, die Rumiceae (Ampferartigen) – zum anderen solche mit 5 Blütenhüllblättern, 8 Staubgefäßen und 3 (2)-zähligen Fruchtknoten, die Polygoneae (Knöterichartigen).
Rumiceae: Während für die noch durch Insektenbestäubung charakterisierte Gattung Rheum die volle Organzahl 6-zähliger Blüten gilt (Blütenformel: P3+3 A6+3 G3), ist bei der windbestäubten Gattung Rumex der innere Staubgefäßkreis ausgefallen (Blütenformel: P3+3 A6+0 G3). Bei Oxyria mit ebenfalls 6 Staubgefäßen geschieht etwas anderes. Von der im Prinzip dreieckig gebauten Blüte wird die dem Betrachter zugewandte (abaxiale) Ecke vollständig eingeschmolzen, so dass eine im Querschnitt querovale Blüte mit 4 Blütenhüllblättern, 6 Staubgefäßen (4+2) und einem linsenförmigen, zweigriffeligen Fruchtknoten entsteht (Blütenformel P2+2 A4+2 G2).
Polygoneae: Wie es zur Entstehung 5-zähliger Polygonaceen-Blüten mit der zahlenmäßig etwas inkonsistenten Blütenformel P5 A8 G3 kam, ist umstritten. Es gibt zwei Deutungen. Die eine sieht die primäre Blütenhülle als eine umgewandelte 5-zählige Hochblatthülle (Quincunx), welche die inneren Organe in Form einer Spirale (bzw. Schraube) mit 2 Umwindungen umhüllt (sog. 2/5 Stellung: Der (Divergenz)Winkel zwischen zwei Blüten beträgt jeweils 144°). Diese Ausgangsform wandelte sich später in zwei auf Lücke stehende 3-zählige Blütenhüllkreise (Divergenzwinkel = 120 °) um. Ein Blütenhüllblatt (das Übergangstepalum 3/6) trennte sich dabei mittels Vervollständigung in zwei separate auf und ein Staubgefäß kam hinzu (Zyklisierung unter Organvermehrung). Demnach wären 5-zählige Blüten ursprünglich, 6-zählige abgeleitet (Quincunxial-Hypothese – roter Pfeil). Die andere Hypothese geht von einer ursprünglich doppelt 3-zähligen Blüte aus. Durch Verschmelzung von zwei benachbarten Blütenblättern (aus 2 verschiedenen Kreisen!) zu einem Doppeltepalum 3/6 entstanden dann 5-zählige Blüten. Dabei ging ein Staubgefäß im äußeren Kreis verloren (Spiralbildung unter Organreduktion). Die entstehende 5-zählige Blütenhülle bildete demnach erst sekundär eine Spirale aus, und wäre abgeleitet (Pseudopentamerie-Hypothese – blauer Pfeil). Übergangstepalum und Doppeltepalum meinen dabei dasselbe Organ, reflektieren aber eine andere Hypothese der Entstehung. Diese „Polygonum“-Struktur P5 A5+3 G3 ist innerhalb der Polygonaceen weit verbreitet. Insgesamt 24 Polygonaceen-Gattungen besitzen sie, darunter Fallopia, Fagopyrum, Polygonum s.str., Bistorta und Aconogonon. Bei Persicaria findet sie sich ebenfalls, aber Reduktionen bis hin zu einer bisymmetrisch-ovalen Blütenform ähnlich wie bei Oxyria sind häufig. (Formel: P5/P4 A4+2 G2). Bei Persicaria amphibia fällt der innere Staubgefäßkreis aus (P5 A5+0 G3). Die nicht umstrittenen Reduktionsentwicklungen sind grau dargestellt.
Zwischen den beiden Gruppen gibt es hinsichtlich des Blütenbaus auch noch Übergänge: So sind die Blütenhüllblätter bei vielen Vertretern der Gattung Atraphaxis in zwei Kreisen angeordnet — außen 2, innen 3 gleichartige Tepalen ohne Übergangspetalum → P2+3 A3+5 A(3). Auch bei Pteroppyrum, Parapteropyrum und Harpagocarpus zeichnet sich eine solche 5-zählig-zweikreisige Struktur ab. Offensichtlich ist bei ihnen das Übergangspetalum auf den innen liegenden Anteil (schwarz gezeichnet) reduziert.
| 6 Blütenblätter | 5 Blütenblätter | 4 Blütenblätter | ||

|
|
|
|

|
| Rheum |
Polygonum, Fagopyrum, Bistorta, Aconogonon, |
Oxyria, Persicaria p. p. | ||
 Rumex |
In beiden Gruppen sind zahlenmäßige Reduktionen über das gezeigte Schema hinaus bei den Blütenorganen (Hüllblätter, Staubgefäße, Fruchtblätter) nicht selten, während Organvermehrung sehr selten ist. So können 5-zählige Arten gelegentlich auch mal 4-zählig sein. Das trifft für Persicaria lapathifolia (Ampfer-Knöterich) sogar regelmäßig zu. Auch bei Persicaria hydropiper und Fallopia convolvulus kommt es häufiger vor. Weitere Reduktion bis hin zu 3 Blütenblättern durch Verwachsung sind dagegen sehr selten. Bei Aconogonon polystachyum findet man umgekehrt gelegentlich regelmäßig gebaute 6-zählig Blüten statt der zu erwartenden 5-zähligen. Bei Rheum-Arten treten mitunter statt 6-zähliger auch 5-zählige Blüten auf (beim Gemüse-Rhabarber Rheum rhabarbarum sogar monströse Blüten mit 7 und mehr Hüllblättern). Diese relativ hohe Plastizität der Blütenstruktur erschwert nicht nur die Systematik der Polygonaceen, sondern gelegentlich auch das Bestimmen der Pflanzen.
Es soll nicht der Hinweis fehlen, dass die dargestellten Blütendiagramme didaktisch etwas vereinfacht sind. In Wirklichkeit stehen die Blütenblüter 1 und 2 nicht waagerecht zur Abstammungsachse, sondern die Blüten sind entweder im Uhrzeigersinn nach rechts oder gegen den Uhrzeigersinn nach links verdreht. Durch diese Anwinkelung passen sich die Blüten besser in ihre kompakte Ausgangslage als Knospen ein. Der regelmäßige Wechsel hängt mit der grundsätzlich sympodialen Verzweigung der Blütenstände zusammen. Aber nicht nur die Anwinkelung der Blüten zur Abstammungsachse, sondern auch der Umlaufsinn der Blüten ändern sich mit jeder Folgeblüte. Der hier dargestellte Umlaufsinn gegen den Uhrzeigersinn ist also nur eine von zwei ganz regelmäßigen Formen und die genau mittige Position des Blütenhüllblatts 4 idealisiert. Der Umlaufsinn selbst ergibt sich aus der Abfolge der Organentstehung bei der embryonalen Blütenentwicklung (vgl. Galle 1977). Das lässt sich im Bezug auf die Blütenhülle z.B. bei Blütenknospen von Polygonum aviculare subsp. aviculare ganz gut beobachten (stärkere Lupenvergrößerung!).
Das Polygonum-s. l.-Problem
Eine beliebte Streitfrage bis in neuere Zeit war, ob die Gattung Polygonum in hergebrachter, weiter Umgrenzung (= s. l.) zu belassen sei, oder ob man sie in mehrere kleinere Gattungen auftrennt, von denen dann nur noch eine Teilgruppe den Namen Polygonum (s.str.) behält. Im Prinzip ist die Frage heute entschieden – Streit herrscht nur noch über die Details. Um eine Aufspaltung kommt man nicht mehr herum und nahezu alle neuen großen Florenwerke nehmen sie vor.
Wie kam es dazu? Linné nahm 1753 die 5-zählige Blütenstruktur vieler Polygonaceen-Taxa zum Anlass, sie entsprechend seinem gerade erdachtem Sexualsystem zu einer einzigen Gattung Polygonum zusammenzuwerfen. Dies hatte praktische, nicht systematischen Gründe. Im Linné’schen Sexualsystem brauchte man nur die Zahl der Blütenorgane zu zählen und hatte in den meisten Fällen dann schon die Gattung. Das revolutionierte das Bestimmen von Pflanzen, denn zählen konnte jeder. Der Nachteil: Gattungen, die heute Coccoloba, Muehlenbeckia, Atraphaxis oder Fagopyrum heißen, wurden von Linné in diesen einen „Topf“ geworfen, obwohl sie nicht näher miteinander verwandt sind. Das Erkennen der wahren Verwandtschaftsgruppen wurde in der Folgezeit durch den Erfolg der Sexualsystem-Methode bis weit ins 19. Jahrhundert hinein behindert. Einige Verbesserungen gelangen später dadurch, dass die oben genannten Gattungen über Fruchtmerkmale neu definiert wurden. Nun spielen in der Evolution aber nicht immer nur auffällige Fruchtbildungen eine Rolle. In gewisser Hinsicht ist die Erwartungshaltung hier größer als die Realität – zumindest bei den Polygonaceen. Taxonomische Gruppen aber, die keine speziellen (auffälligen) Früchte ausbilden, sind noch lange nicht miteinander verwandt. Verwandtschaftsanzeigend sind letztlich immer nur Neubildungen (Apomorphien), die zudem von Parallelentwicklungen zu unterscheiden sind. Merkmale wie Lebensform, Habitus, Blattform, Blütenstandsform, Blütenform, Blütenfarbe und Zahl der Blütenorgane, alles das also, was sich dem Auge auf den ersten Blick erschließt, hat im Hinblick auf systematische Brauchbarkeit bei den Polygonaceen nur beschränkte Bedeutung, vor allem dann, wenn man die Verhältnisse weltweit betrachtet. Die systematisch aussagekräftigen, gut korrelierten Neubildungen bei den Polygonaceen gehören „leider“ zu den weniger auffälligen Merkmalen. Zu nennen sind Typen von Haaren, Nektarien, Pollenkörnern, Blütenblattnervaturen und Fruchtschalenaufbau – alles Merkmale kleiner bis kleinster Dimensionen. Dass solche Merkmale deswegen geringfügig seien, ist abwegig. Dann sonst hätten Grün- und Blaualgen oder Bakterien aufgrund ihrer geringen Größe überhaupt keine wichtigen Merkmale. Entscheidend ist nicht die optische Auffälligkeit von Merkmalen, sondern ihre Korrelation und Verlässlichkeit, ihr Vorhersagewert. Die Kleinheit der Blüten und die der systematisch relevanten Merkmale kommt dem Nutzer natürlich nicht entgegen. Doch es war auch nie das Ziel von Pflanzenarten, ihre Identität uns in möglichst auffälliger Weise kundzutun! Auf Einzelmerkmale sollte man sich – weil bequemer – nie ganz verlassen. Der Gesamt-Merkmalszusammenhang muss stimmen. Aus diesem Grund ist z. B. für Aconogonon polystachyum eine eigene Gattung Rubrivena überflüssig, da sie sich nur auf einen abweichenden Pollentyp stützt, der oberflächlich Ähnlichkeit mit dem von Persicaria hat. Pollenkorn-Merkmale haben zweifellos ein hohen systematischen Wert, aber sie haben es nie per se, sondern nur in Korrelation mit anderen guten Merkmalen.
Dessen eingedenk wurde in der Standardliste (Wißkirchen & Haeupler 1998) das in Fachkreisen schon seit langem diskutierte neue System für Deutschland eingeführt, wenig später gefolgt von „Flora Nordica“ (Jonsell 2000), zuletzt auch von der „Flora of North America“. Osteuropäische Länder hatten es schon lange vorher verwendet. Inzwischen bestätigen unabhängige molekularsystematische Untersuchungen diese „neue“ Sichtweise, die vor allem von Gross (1913), Hedberg (1950) und Haraldson (1978) entwickelt worden war. Pollenmorphologen arbeiten schon lange mit diesem System, da es einen Polygonum s. l.-Pollenkorntyp nicht gibt. Es ist kein Zufall, dass die Neugliederung zu einem guten Teil mit dem überein stimmt, was Tournefort bereits 1697 in seinem Werk „Institutiones Rei Herbarii“ dargelegt hat und vor ihm schon Bauhin namentlich auflistete. Linné verwendete diese Systematik anfänglich genauso, war aber gezwungen, sie zu verlassen, da sein Sexualsystem damit kollidierte. Auch er unterschied früher Bistorta, Persicaria (incl. Aconogonon), Polygonum (s. str.) und Helxine (Fallopia + Fagopyrum). In Species Plantarum (Linné 1753) behielt er sie als Untereinheiten auch bei.
Wie künstlich das Linné‘sche Sexualsystem bei den Polygonaceen war, zeigt sich z. B. daran, dass Linné (1753) eine neue Gattung Atraphaxis auf eine Art (A. spinosa) mit 4-zähligem Perigon gründete, während er eine andere Atraphaxis-Art (A. frutescens) mit 5-zähligen Blüten, ansonsten aber völlig gleichen Merkmalsstrukturen, bei Polygonum einordnete. Weiterhin beschrieb Linné den Säuerling (Oxyria digyna) als Rumex-Art (Rumex digynus L.), da dieser ja wie Rumex 6 Staubgefäße besitzt – ohne zu sehen, dass bei Rumex die 6 Staubgefäße im äußeren Kreis stehen (der innere fehlt), während es bei Oxyria nur 4 im äußeren Kreis sind und 2 sich im inneren Kreis befinden. Seine Gattung Koenigia schließlich gründete er auf Pflanzen mit dreizähligen Blüten. Das trifft selbst auf Koenigia islandica nur teilweise zu, schon gar nicht auf die anderen Koenigia-Arten, die alle 5- oder 4-zählige Blüten haben und nach der Logik des Sexualsystems Polygonum heißen müssten.
Heute wird durch Vergleich von Gensequenzen im Detail bestätigt, was man aufgrund morphologischer und anatomischer Merkmale schon wusste oder zumindest ahnte, nämlich, dass Polygonum s.str. mit Atraphaxis verwandt ist (breite Filamentbasis, ähnliche Perigonnervatur), Fallopia mit Muehlenbeckia (extraflorale Nektarien), Aconogonon mit Bistorta und Koenigia (spezifische Ausprägung der Floralnektarien), während Persicaria zu letzteren offenbar das Geschwistertaxon darstellt, und Fagopyrum zu all diesen sehr isoliert zu stehen scheint – mit anderen Worten: Ein Polygonum s. l. als Verwandtschaftsgruppe hat es nie gegeben! Es handelt sich um eine Ähnlichkeitsgruppe, ein Konglomerat aus fünf Verwandtschaftsgruppen, von denen nur Aconogonon und Bistorta näher miteinander in Verbindung stehen. Von daher muss auch der Abschied nicht schwer fallen. Rheum, Rumex und Oxyria konnten mit molekularer Methodik dagegen als Verwandtschaftsgruppen (der Rumiceae) in traditioneller Umgrenzung bestätigt werden. Somit besteht kein Anlass zur Befürchtung, dass die neue Systematik ein Fass ohne Boden sei. Eine Änderung könnte es möglicherweise noch geben: Galasso et al. (2009) fanden heraus, dass ihre Gattungen Aconogonon (s.str.), Koenigia und Rubrivena ganz eng miteinander verwandt sind und als Geschwistergruppe zu Bistorta fungieren. Da Rubrivena polystachya von mir als Aconogonon polystachyum bewertet wird, ist die Notwendigkeit für drei Gattungen m. E. nicht gegeben. Und Koenigia-Arten sind vermutlich auch nichts anderes als Zwergformen von Aconogonon. Möglicherweise ist neben Bistorta nur Platz für eine zweite Gattung, die dann aber aus nomenklatorischen Gründen Koenigia heißen müsste.
Leider hat die von Ronse Decraene & Akeroyd (1988) propagierte Alternativzerlegung in ein eng gefasstes Polygonum und eine weit gefasste Gattung Persicaria für Verwirrung und unnötiges Umlernen gesorgt. Sie war als Kompromisslösung zwischen „lumping“ und „splitting“ gedacht, bereichert aber nur die schon gut gefüllte Liste entbehrlicher Namen. Wie die Übersicht in Tabelle 1 zeigt, bietet Persicaria s. l. (incl. Bistorta und Aconogonon) zu wenig gemeinsame Merkmale, um eine in der Praxis brauchbare Gattungsumgrenzung zu liefern. Dass diese drei Gruppen untereinander ähnliche Epidermis-Oberflächen haben, kann man anerkennen. Doch welcher Florist, Naturschützer oder Gärtner hat schon ein Raster-Elektronenmikroskop auf seinem Schreibtisch herumstehen, um das zu verifizieren. In der langen Historie des Polygonum s. l. steht dieser eher akademische Vorschlag isoliert da.
Warum aber kann nicht trotzdem alles wie bisher Polygonum heißen; das wäre doch viel einfacher? Einfacher ja, aber man hätte sonst nichts davon. Nur auf der Grundlage echter Verwandtschaften können Erkenntnisse über Inhaltsstoffe, Nutzpflanzenverwendung, Evolution, Areal, Ökologie, palaeobotanische Entstehung, Beziehungen zu Pflanzen und Tieren, Kreuzbarkeit etc. gewonnen werden. Der Nutzen für die Pollenmorphologie wurde bereits erwähnt. Für die Palaeontologie sind die Erkenntnisse über die realen Verwandtschaftsgruppen von großer Bedeutung. Fruchtfunde der Gattung Persicaria sind z. B. schon seit dem frühen Tertiär (vor 65 Millionen) in Mitteleuropa nachgewiesen. Diese Gattung ist als einzige weltweit und zugleich auch im tropischen Flachland verbreitet. Eine Gattung Bistorta als reine Hochgebirgsgruppe konnte dagegen erst gegen Ende des Tertiärs vor 10–20 Millionen entstehen, nachdem der nach Norden driftende indische Subkontinent auf die eurasische Platte prallte und dabei den Himalaya auffaltete. Will man die geographische gebundene Entwicklung (Evolution) der Pflanzenwelt, die Ausbreitung (Radiation) bestimmter Verwandtschaftsgruppen auf dem Hintergrund von Kontinentalverschiebung und Eiszeiten richtig verstehen, muss man diese Verwandtschaftsgruppen sauber trennen. Während Persicaria-Arten also bereits fester Bestandteile der alten tropischen Tertiärflora waren, kam Bistorta erst im Pleistozän nach Europa. Denn erst die Kältebrücke des von Norden vorrückenden Eises ermöglichte dieser an kühle Klimate angepassten Himalaya-Gattung eine Wanderung nach Westen (vgl. Kadereit et al. 2008). Auf gleichem Wege kam übrigens auch das Edelweiß zu uns. Bistorta officinalis, B. vivipara, Aconogonon alpinum, Oxyria digyna, Koenigia islandica und Rheum rhaponticum sind Hinterlassenschaften hauptsächlich kaltzeitlicher Wanderungs- bzw. Ausbreitungsbewegungen.
Andere Gesichtspunkte betreffen z. B. die Inhaltsstoffe der Pflanzen. Junge Blätter des heimischen Schlangenknöterichs sind essbar: Das nordenglische Städtchen Mytholmroyd im Calder Valley veranstaltet jedes Frühjahr ein Wettkochen mit Schlangenknöterich-Blättern als wichtigster Zutat, das “World Dock Pudding Championship” – die Wiederbelebung einer jahrhundertealten Tradition, ursprünglich ein Arme-Leute-Essen, dass nach dem Winter mit Vitaminen und Mineralstoffen den Menschen wieder neue Kraft geben sollte. Die Bistorta-Wurzel liefert auch eine pharmazeutische Droge. Solche Eigenschaften gelten für die oberflächlich ähnlichen Arten der Gattung Persicaria nicht, und der Genuss ihrer Blätter kann zu Vergiftungen führen. Trockene mediterrane Standorte, Steppen und Halbwüsten kennzeichnen den Schwerpunkt der Gattung Polygonum s.str. vom östlichen Mittelmeer bis nach Afghanistan. Der ökogeographische Zusammenhang mit Atraphaxis wird dabei deutlich. Im Nordamerika ist der Schwerpunkt der Gattung Polygonum entsprechend im trockenen Südwesten der USA zu finden. Ackerunkräuter und Trittpflanzen frischer Standorte wie Polygonum aviculare und Polygonum arenastrum subsp. arenastrum scheinen dem zu widersprechen. Doch handelt es sich dabei um Pflanzen, die erst in der menschlichen Kultur entstanden sind. Betrachtet man dagegen die Standorte von natürlichen Sippen wie Polygonum arenastrum subsp. calcatum oder microspermum auf den Sandbänken von Flüssen oder von Polygonum maritimum und Polygonum oxyspermum am Meeresstrand, dann ist der Zusammenhang mit der ökologischen Grunddisposition der Gattung wieder gegeben. Die Strand- und Uferstandorte sind nämlich trotz ihrer Nähe zum Wasser ziemlich trocken. Dass bei Polygonum s.str. die Blätter vorgeformte Trennstellen besitzen, ist eine Anpassung an solche Standorte. Entscheidender Vorteil einer in natürliche, stammesgeschichtliche Einheiten zerlegten Verwandtschaftsgruppe ist also ihr Vorhersagewert. Ein solcher war bei dem Linné’schen Polygonum s. l. nicht gegeben.
Widerstand gegen die Aufspaltung von Polygonum s. l. kommt heute noch von gärtnerischer Seite. Betrachtet man die Sache aber genauer, stellt sich heraus, dass vor allem Aconogonon und Bistorta, die ja auf den ersten Blick gut unterscheidbar sind, attraktive Sortimente für Staudenbeete liefern, während Persicaria nur Einzelelemente beisteuert und Polygonum scoparium die einzige echte Polygonum-Art der Gärten ist. Die Züchtung neuer Pflanzen durch Kreuzung und Selektion kann nur gelingen bzw. ist nur dann effektiv, wenn man weiß, was miteinander verwandt ist. Sogar Kreuzungen von Aconogonon- mit Bistorta- und Koenigia-Arten sind unter systematischen Gesichtspunkten vorstellbar, auch wenn die Pflanzen wohl steril sein werden. Das stört aber nicht, denn die gut 2 Meter hohe, sehr erfolgreiche neue Staude Aconogonon „Zauberwolke“ ist das auch. Sie beweist, welches gärtnerisches Potential in den Pflanzen steckt.
Eine wichtige Frage ist natürlich: Woran aber erkennt man die neuen Gattungen des bisherigen Polygonum s. l. am einfachsten? Folgende Kurzcharakteristik mit je 2–3 Merkmalen kann gegeben werden:
- Polygonum: gelbe Staubgefäße, stark verbreiterte Filamentbasen, oben „silbrig“ zerschlitzte Ochrea
- Fallopia: Grubennektarium direkt unter dem Ansatz des Blattstiels am Stängel, Blüten geflügelt
- Fagopyrum: Blätter breit spießförmig, Nussfrüchte sehr viel länger als Blütenhülle, Haarleiste am Stängel
- Bistorta: nur 1 dichtblütige Scheinähre, Narben wie kleine Glaskügelchen, Blattrandnerven verdickt
- Persicaria: 2 oder mehr Scheinähren, Pinselhaare, Einzelnektarien zwischen den Filamenten
- Aconogonon: Blütenstände traubig-rispig, Kapillarhaare, Nussfrüchte oft länger als die Blütenhülle
Kleiner Exkurs Phylogenie:
Apomorphien (Neubildungen) sind Merkmale, die in der Evolution neu entstehen. Echte stammesgeschichtliche (phylogenetische) Verwandtschaft kann nur auf solche Neubildungen gegründet werden. Im vorliegenden Fall ist es die Bildung einer Scheinbeere bedingt durch das nach der Blüte (postfloral) starke Anschwellen und Entfärben des Blütenbodens. Die Blütenhüllblätter sind als kleine Zipfel noch erkennbar. Es sind die typischen Früchte der Gattung Muehlenbeckia (erstes Bild rechts).
Plesiomorphien (Altbildungen) sind dagegen Merkmale, die es schon länger gibt und die bei phylogenetischen Aufspaltungen beibehalten bzw. weiter vererbt werden. Typischerweise sind sie weit verbreitet. Im vorliegenden Fall ist es die 5-zählige, einfache grünliche Blütenhülle ohne postflorale Veränderung (zweites Bild rechts). Eine derartige Frucht würde man unter traditionellen Gesichtspunkten zu Polygonum (u. U. sogar im engen Sinne) stellen.
Tatsächlich wurden beide Bilder von der gleichen Pflanze gemacht, die im Botanischen Garten in Bonn wächst. Das rechte Bild zeigt das Fehlschlagen der Muehlenbeckia-typischen Fruchtbildung, den Rückfall bzw. das Verharren in einem ursprünglichen (plesiomorphen) Zustand.
Der durch den Widerspruch – gleiche Pflanze, verschiedene Gattungs-Zuordnung – offenbar werdende Fehler zeigt, dass die Verwendung von plesiomorphen Merkmalen leicht zu künstlichen Gruppierungen führt – wie im Fall des Linné'schen Polygonum.
Übersicht der Merkmale des früheren Polygonum s. l.
Tabelle 1: Diagnostisch wichtige Gattungsmerkmale sind in roter Schrift dargestellt. Rot unterlegt sind solche Merkmalsausprägungen, die nur bei jeweils einer Gattung vorkommen (Apomorphien) und so die Gattung in spezifischer Weise kennzeichnen. Abkürzungen: D = Artenzahl Deutschland, Ges. = Gesamtartenzahl, unter Kultur: sind Kulturpflanzen aufgelistet, teilw. = teilweise, äuß. = äußere.
| Gattungen des ehem. “Polygonum s.l.” |
Fagopyrum s.str. (Buchweizen) |
Aconogonon (Bergknöterich) |
Bistorta (Wiesenknöterich) |
Persicaria (Knöterich) |
Polygonum s.str. (Vogelknöterich) |
Fallopia s.l. (Flügelknöterich) |
| Artenzahl D (Ges.): (E = eingebürgert) |
2 (15): esculentum, tataricum Kultur: dibotrys (E, medit.) |
1 (30): polystachyum (E) Kultur: alpinum, weyrichii, campanulatum, sericeum, divaricatum, “polymorphum” (alpinum × weyrichii?) |
2 (25): officinalis, vivipara Kultur: affinis, amplexicaulis, vaccinifolia, rubra (“milletii”), tenuicaulis, macrophylla |
7 (100): amphibia, lapathifolia, maculosa, hydropiper, mitis, minor, pensylvanica (E) Kultur: nepalensis (E?), orientalis, tinctoria, odorata, virginiana/filiformis |
4 (60): oxyspermum, raii, arenastrum, aviculare Kultur: scoparium |
6 (15): baldschuanica (E?), convolvulus, dumetorum, japonica (E), sachalinensis (E), × bohemica (E) Kultur: baldschuanica, früher auch: japonica, sachalinensis |
| Chromosomengrundzahl | x = 8 | x = 10 (11, 8?) | x = 11 (12?) | x = 11, 10 | x = 10 | x = 10, 11 |
| Hauptareal (u. Regionen mit mind. 3 Arten) | mittelasiatische Hochgebirge (Himalaya) | mittelasiatische Hochgebirge (Himalaya), Ostasien, 3 Arten in N-Amer., Eur.: 1 Art | mittelasiatische Hochgebirge (Himalaya) – N-Amer. u. Eur. 2 Art. im Zuge d Eiszeit | ± weltweit (boreal)‒temperat‒pantropisch, rel. slt. in Trockengebiet. u. Gebirgen | meridionale Trockengebiete, Mittelmeergebiet bis Mittelasien, westl. Nordamerika | gemäßigtes Mittel- bis Ostasien und Nordamerika (in Europa 2 Arten) |
| Ökologie | ?, sek. kultiviert, segetal, ruderal | montane-alpine Rasen, Staudenfluren, lichte Gebirgswälder, Ufer | montane-alpine Rasen, Staudenfluren, sek. im montanen Grünland | Pionierfluren, Altwasser, Röhrichte, feuchte lichte Wälder, sek. ruderal | sandige Küsten und Flussufer, trockene Rasen, Steppen, sek. ruderal u. segetal | Waldränder, Gebüsche, Uferstauden, sek. segetal u. ruderal |
| Lebensform / Wuchsform | aufrechte sommerannuelle Kräuter, Rhizomstauden, slt. Lianen-artig | aufrechte Rhizomstauden, teilw. hochwüchsig | aufrechte Rhizomstauden, meist niedrigwüchsig, Zwergsträucher | aufsteig. sommerannuelle Kräuter, Rhizomstauden, slt. Wasserpflanzen | annuelle aufrechte – liegende Kräuter, Rhizomstauden und Halbsträucher | sommerannuelle, perennierende oder holzige Lianen, hohe Rhizomstauden |
| Blattanordnung | am ganzen Spross | am ganzen Spross, slt. ± halbrosettig | meist halbrosettig, bei Holzpfl. gleichmäßig an Trieben | am ganzen Spross | am ganzen Spross | am ganzen Spross, bei Holzpfl. an Kurztrieben gebüschelt |
| Ochrea-Struktur | offen, kurz, oben sehr schief bis zum Grund abgeschnitten, Rand etwas umgefaltet | spitztütig geschlossen | spitztütig geschlossen, lang, slt. infolge Gewebezerfall scheinbar mit Cilien | offen, zylindrisch, oben gerade od. schief abgeschnitten, oft mit Cilien | durch spitze Zipfel verschlossen oder kurz stumpf rundl. geschlossen | spitztütig geschlossen, teilweise mit kleiner, seitl. apikaler Öffnung |
| Blattstiel mit Abszission | slt. | ‒ | sehr slt. | ‒ | stets | häufig |
| Blattrandnerven | ‒ | ‒ | In der Regel verdickt | ‒ | ‒ | ‒ |
| Extrafloral-Nektarien | ‒ | ‒ | ‒ | ‒ | ‒ | stets unterh. Blattstielansatz |
| Haare | einfache einzellige Haare, meist kurz, weich, stumpflich, Stängel mit Haarleisten | lange, Kapillarhaare (Längs-Feinstruktur), teilw. sternförm. gruppiert, slt. Filzhaare | einfache einzellige Haare, meist kurz, weich, stumpflich, oder Pfl. kahl | mehrreihige, meist zu Blattspitze gerichtete, spitze Büschelhaare, mitunter Filzhaare | kahl | ein- bis wenigzellige einreihige Haare, slt. lange Kapillarhaare (Papillen-Feinstruktur) |
| Blütenstand | end- und seitenständige traubige bis doldenrispige Blütenstände | end- und seitenständige, stark verzweigte Rispen, mitunter traubig vereinfacht | einzelne endständige, seltener auch seitenständige, sehr dichte Scheintrauben | end- und seitenständige lockere‒dichte Scheintrauben, doldig angeordn. Köpfchen | einzeln blattachselständig, apikal oft zunehmend locker-traubig aggregiert | end- und seitenständige, etwas lockere Scheintrauben oder Rispen |
| Fruchtgröße in Relation zum Perigon | deutlich (> 2 x) länger als das Perigon | oft länger als das Perigon, aber selten 2 × so lang | etwa so lang wie das Perigon | etwa so lang wie das Perigon, oder kürzer | etwa so lang wie das Perigon, slt. länger | meist kürzer als das Perigon |
| Perigon geflügelt | ‒ | ‒ | ‒ | ‒ | ‒ | äußere Tepalen fast immer |
| Tepalennervatur-Muster | trifid (Längsparallel-Muster) | trifid | trifid | trifid | dendrit bis retikulat | dendrit |
| Floral-Nektarien | 8 einzelne, interstaminale, kegel-kugelförmig Nektarien | 3 Doppelnektarien, mit den Basen der inneren Stamina verwachsen, 2 einzel. ± frei | 3 Doppelnektarien, mit den Basen der inneren Stamina verwachsen, 2 einzel. ± frei | 5‒8 einzelne, interstaminale, kegel-kugelförmige Nektarien | nur eine ringförmige basale Nektarzone, morphologisch kaum ausgeprägt | nur eine ringförmige basale Nektarzone, morphologisch kaum ausgeprägt |
| Filamentbasis | ‒ | ‒ | ‒ | ‒ | deutlich abgesetzt verbreitert | wenig allmählich verbreitert |
| Antheren-Öffnungsweise | äuß.: intrors, innere: extrors | äuß.: intrors, innere: extrors | äuß.: intrors, innere: extrors | äuß.: intrors, innere: extrors | alle intrors | alle intrors |
| Antherenfarbe | rosa | rosa, weiß | rosa, violett, rot | rosa, weiß | gelb | weiß |
| Griffel | 3, kurz oder lang, frei | 3, meist kurz bis höchstens mäßig lang, frei | 3, sehr lang und schlank, frei, bas. etwas verwachsen | 2‒3, mäßig lang, teilw. bis gut ½ verwachsen | 3, sehr kurz, frei | 3, sehr kurz, frei bis stark verwachsen |
| Narbe | kopfig | kopfig, warzig | klein, kugelförmig, glatt, glänzend | kopfig | kopfig | kopfig, warzig, oder länglich, etwas fransig zerteilt |
| Pollenkörner | ellipsoid, 3-colporat, semitectat-microreticulat, Collumellae verzweigt | rund, 3 (–6)-colpat, tectat-foveolat mit microspinulae, slt. semitectat-reticulat | ellipsoid, 3-colporat, tectat-punctat (scabrae), Collumella verzweigt | rund, 12‒27 pantoporat / colpat (3-colpat), semitectat-reticulat | kantig ellipsoid, 3-colporat od.4‒12 pantocolporat, tectat-punctat, mit granulae | rund-ellipsoid, 3-colporat, tectat, um die Colpi herum mit scabrae |
Literatur
- Anjen, L. et al. (2003): Polygonaceae. In: Zhengyi, W. & Raven, P.H. (2003): Flora of China Vol. 5. (S. 277-350) - Science Press & Missouri Botanical Garden Press, Bejing & St. Louis.
- Brandbyge, J. (1993): Polygonaceae. In: Kubitzki, K., Rohwer, J. G. & Bittrich, V., The Families and Genera of Vascular Plants, 2: 531–544, Springer, Berlin, Heidelberg, New York.
- Burke, J.M. (2010): Placing the woody tropical genera of Polygonceae: A hypothesis of character evolution and phylogeny. - Am. J. Bot. 97: 1377-1390.
- Carlquist, S. (2003): Wood anatomy of Polygonaceae: analysis of a family with exceptional wood diversity. – Bot. J. Linn. Soc. 141: 25–51.
- Dammer, U. (1893): Polygonaceae. In: Engler, A. und Prantl, K. (Hrsg.): Die natürlichen Pflanzenfamilien III, Teil 1a. – Engelmann, Leipzig.
- Freeman, C.C. & Reveal, J.L. (2005): Flora of North America: North of Mexico. Vol. 5.
- Galasso, G. et al. (2009): Molecular phylogeny of Polygonum L. s. l. (Polygonoideae, Polygonaceae), focusing on European taxa; preliminary results and systematic considerations based on rbcL plastidial squence data. – Atti Soc. it. Sci. nat. Museo civ. Stor. nat. Milano 150: 113–148.
- Galle, P. (1977): Untersuchungen zur Blütenentwicklung der Polygonaceen. – Bot. Jahrb. Syst. 98 (4): 449–489.
- Geitler, L. (1929): Zur Morphologie der Blüten von Polygonum. – Österr. Bot. Z. 78 (3): 229–241.
- Gesellschaft Schweizer Staudenfreunde (2009): Polygonaceae. Knöterichgewächse. – Schweizer Staudengärten 38. Wädenswill.
- Gross, H. (1913): Beiträge zur Kenntnis der Polygonaceen. – Bot. Jahrb. Syst. 49: 234–339.
- Haraldson, K. (1978): Anatomy and Taxonomy in Polygonaceae subfam. Polygonoideae Meisn. emend. Jaretzky. – Symb. Bot. Upsal. 22 (2): 1–93.
- Hedberg, O. (1946): Pollen Morphology in the genus Polygonum L. s. lat. and its taxonomical significance. – Svensk Bot. Tidskr. 40 (4): 371–404.
- Hong, S.-P. (1993): Reconsideration of the generic status of Rubrivena (Polygonaceae, Persicarieae). – Plant Syst. Evol. 186: 95–122.
- Kadereit, J. W., Licht, W. & Uhink, C. H. (2008): Asian relationship of the flora of the European Alps. – Plant Ecology & Diversity 1 (2): 171–179.
- Karlsson, T. (2000): Polygonaceae. In: Jonsell, B. (ed.): Flora Nordica 1 (S. 235-318). - Bergius Foundation. The Royal Swedish Academy of Science, Stockholm.
- Kim, S.-T. & Donoghue, M. J. (2008): Molecular phylogeny of Persicaria (Persicarieae, Polygonaceae). – Systematic Botany 33: 77–86.
- Kubitzki, K. (1987): Origin and significance of trimerous flowers. – Taxon 36: 21–28.
- Lamb-Frye, A. S. & Kron, K. A. (2003): Phylogeny and character evolution in Polygonaceae. – Syst. Bot. 28: 326–332.
- Leeuwen, P. van, Punt, W. & Hoenn, P. P. (1988): The Northwest European Pollen Flora, 43. Polygonaceae. – Rev. Palaeobot. Palynol. 57: 81–151.
- Lersten, N. R. & Curtis, J. D. (1992): Foliar anatomy of Polygonum (Polygonaceae): survey of epidermal and selected internal structures. – Pl. Syst. Evol. 182: 71–106.
- Rechinger, K. H. (1958): Polygonaceae. In: Hegi, G., Illustrierte Flora von Mitteleuropa, 2.Aufl. Bd. 3, Teil 1 (S. 352–436), Berlin .
- Ronse Decraene, L. P. & Akeroyd, J. R. (1988): Generic limits in Polygonum and related genera (Polygonaceae) on the basis of floral characters. – Bot. J. Linn. Soc. 98: 321–371.
- Ronse Decraene, L. P. & Smets, E. (1991): The Floral Nectaries of Polygonum s. l. and related genera (Persicarieae and Polygoneae). – Flora 185: 165–185.
- Ronse Decraene, L. P., Hong, S. P. & Smets, E. (2000): Systematic significance of fruit morphology and anatomy in tribes Persicariae and Polygoneae (Polygonaceae). – Bot. J. Linn. Soc. 134: 301–337.
- Sanchez, A. & Kron, A. K. (2008): Phylogenetics of Polygonaceae with an Emphasis on the Evolution of Eriogonoideae. – Systematic Botany 33: 87–96.
- Sanchez, A. & Kron, A. K. (2009): Phylogenetic relationship of Afrobrunnichia Hutch. & Dalziel (Polygonaceae) based on three chloroplast genes and ITS. – Taxon 58 (3): 781–792.
- Sanchez, A., Schuster, T. M. & Kron, K. A. (2009): La Large-Scale Phylogeny of Polygonaceae based on Molecular Data. – International Journal of Plant Science 170 (8): 1044–1055.
- Wisskirchen, R. (1998): Polygonum. In: Wisskirchen, R. & Haeupler, H., Standardliste der Farn- und Blütenpflanzen Deutschlands: 375–377. – Ulmer, Stuttgart.

